Co to są inhibitory
World Federation of Hemophilia (WFH) nie jest zaangażowana w praktykę medyczną i nie wydaje zaleceń dotyczących leczenia poszczególnych osób. Nie sugeruje też schematów dawkowania leków. Metody leczenia są stale zmieniane, pojawiają się również nowe działania niepożądane. WFH nie składa żadnych oświadczeń dotyczących poprawności dawek leków lub innych zaleceń medycznych przedstawionych w publikacji. Z tego względu przed podaniem jakiegokolwiek leku, o którym mowa w niniejszej publikacji, WFH zaleca, aby osoby, które szukają porady, zasięgnęły jej u lekarza i/lub zapoznały się z informacjami o leku dostarczonymi przez firmę farmaceutyczną. World Federation of Hemophilia nie wspiera poszczególnych produktów, metod leczenia ani producentów; jakiekolwiek odniesienia do konkretnych nazw leków nie są ich reklamą.
WSTĘP DO WYDANIA POLSKIEGO
Inhibitor czynnika krzepnięcia to najczęstsze powikłanie leczenia hemofilii. W efekcie jego pojawienia się dotychczas stosowane leczenie przestaje działać.
Obecnie coraz częściej stosuje się nowoczesne metody eliminowania inhibitora. Chociaż wywoływanie immunotolerancji może trwać długo i bywa uciążliwe, to jednak u ponad 80% pacjentów kończy się wyeliminowaniem inhibitora. Tak stało się w przypadku Maksa, u którego inhibitor pojawił się, gdy chłopiec miał 2 lata.
Pierwsze siniaki pojawiły się u Maksa, gdy miał 9 miesięcy.
W szpitalu w Kielcach postawiono diagnozę i odesłano nas do Kliniki Hematologii szpitala przy ul. Marszałkowskiej w Warszawie. Okazało się, że Maks ma hemofilię A, postać ciężką.
Przystosowaliśmy dom, by chronić Maksa przed urazami. Podłogę wyłożyliśmy gąbką, na nią położyliśmy dywan, zabezpieczyliśmy też wszystkie szafki, drzwi. Zakładaliśmy mu też ochraniacze na łokcie i kolana.
Gdy Maks miał 2 lata, zdiagnozowano u niego inhibitor. Podawany po wylewach czynnik VIII przestał działać. Lekarze zaproponowali nam wejście do programu wywoływania immunotolerancji.
W maju 2001 r. Maksowi założono vascuport, czyli centralne dojście do żyły głównej. Synek dostawał codziennie po 1500 jednostek VIII czynnika krzepnięcia. Poziom inhibitora szybko zaczął spadać, jednak we wrześniu znów wzrósł. Lekarze przekonali nas jednak, że warto nadal próbować walczyć. Rzeczywiście, wkrótce poziom inhibitora zaczął spadać. Do maja 2004 r., przez 3 lata, codziennie podawaliśmy Maksowi czynnik. Przeciwciała spadły i utrzymywały się na niskim poziomie, lekarze zalecili więc, by stopniowo zmniejszać ilość podań - z siedmiu do sześciu w tygodniu, potem do pięciu, czterech, trzech. Zmniejszaliśmy też ilość jednostek czynnika. W listopadzie 2008 r. poziom inhibitora spadł poniżej 0,5 j.B. Immunotolerancja się udała, choć wszystko trwało kilka lat. Mogliśmy wejść do programu profilaktycznego dla dzieci!
Czy podawanie przez tyle lat codziennie czynnika nie było uciążliwe? Gdy wszczepiano vascuport, synek miał 3,5 roku. Bał się lekarzy, wkłuć, miał słabe żyły. Przekonaliśmy go, że pojedziemy do Warszawy, będzie miał wszczepione pod skórę takie "małe kółeczko", jak określiliśmy vascuport, i wrócimy do domu. Zgodził się. Nigdy nie mieliśmy problemu z podawaniem czynnika. A dziś Maks sam się o to dopomina.
Z hemofilią można sobie poradzić, jak z każdą chorobą. Owszem, Maks ma pewnie ograniczenia: nie gra w piłkę nożną, nie szaleje na rolkach, ale w domu ma hantle, chodzi też na basen. Gra w szachy - był mistrzem Polski młodzików, jest w kadrze wojewódzkiej, ma stypendium sportowe z urzędu miasta. Jest też laureatem konkursu matematyczno-przyrodniczego, ma sukcesy w konkursach humanistycznych, dzięki czemu został zwolniony z egzaminu dla szóstoklasistów (od razu dostał maksymalną ilość punktów). Może sobie wybrać gimnazjum. Wszystko przed nim!
Odczulanie się udało i to jest dowód na to, że warto próbować. Zachęcam wszystkich, by pomimo wszelkich przeciwności nie poddawali się. Leczenie w Polsce chorych z inhibitorami bardzo się poprawiło, należy wykorzystać szansę wyeliminowania inhibitora, jaką jest immunotolerancja.
Marek Szymanowicz, tata 13-letniego Maksa
Czym są inhibitory
W wyniku niepożądanej reakcji układu immunologicznego na leczenie koncentratem czynnika krzepnięcia u niektórych chorych na hemofilię pojawia się poważny problem medyczny - inhibitor.
System odpornościowy ma za zadanie chronić organizm przed szkodliwymi czynnikami zakaźnymi, bakteriami i wirusami. Czasami jednak, gdy układ immunologiczny nie zetknął się wcześniej z czynnikiem krzepnięcia, reaguje na niego tak, jak gdyby był on obcą, szkodliwą substancją. Wytwarza wówczas przeciwciała (zwane inhibitorem), które krążą we krwi i zwalczają podawany czynnika krzepnięcia. Nie może on wtedy pełnić swojej roli w prawidłowym procesie krzepnięcia krwi.
Inhibitory neutralizują podawane koncentraty czynników krzepnięcia
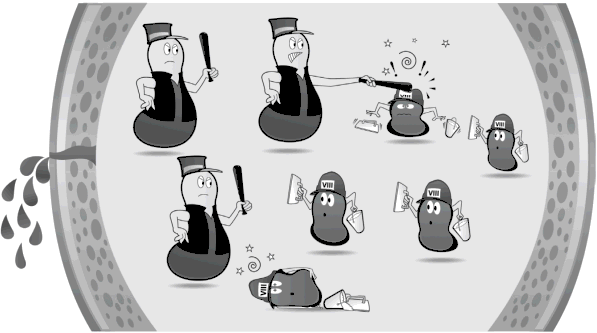
Obecnie największym wyzwaniem w leczeniu chorych na hemofilię jest terapia chorych z inhibitorami czynnika krzepnięcia. U chorego na hemofilię, u którego rozwinął się inhibitor, krwawienia są bardzo trudne do opanowania i przez to zwykle bardziej bolesne. Jeśli krwawienia do stawów i mięśni (najczęściej pojawiają się właśnie takie) nie są właściwie leczone, to doprowadzają do trwałego uszkodzenia stawów i mięśni. W leczeniu krwawień u chorych na hemofilię powikłaną inhibitorem czynnika krzepnięcia stosuje się tzw. leki omijające inhibitor.
Jedyną metodą leczenia, która umożliwia wyeliminowanie inhibitora czynnika krzepnięcia, jest immunotolerancja. Trzeba jednak zaznaczyć, że wymaga ona specjalistycznych umiejętności, jest też długotrwała.
KTO JEST NARAŻONY NA POWSTANIE INHIBITORA
Inhibitory pojawiają się znacznie częściej u chorych na ciężką postać hemofilii niż u tych, którzy mają umiarkowaną i łagodną postać choroby (postaci choroby omówione są dalej).
U 95% osób, u których wytworzył się inhibitor, pojawił się on podczas pierwszych 50. podań koncentratu czynnika krzepnięcia. Ryzyko wystąpienia inhibitora czynnika krzepnięcia jest największe podczas pierwszych 20. podań leku. Inhibitory pojawiają się na ogół u dzieci chorych na ciężką postać hemofilii. Mogą one jednak również wystąpić w późniejszym okresie życia, nawet u osób z łagodną lub umiarkowaną postacią hemofilii.
Inhibitory powstają u około 25-30% dzieci chorych na ciężką postać hemofilii A (mających niedobór VIII czynnika krzepnięcia). Nie oznacza to jednak, że tak wielu chorych na ciężką postać hemofilii A ma inhibitor. U części osób inhibitory mają bowiem niskie miano i te, najczęściej, samoistnie przemijają. U innych można je wyeliminować za pomocą odpowiedniego leczenia. Występowanie inhibitorów w losowo wybranej grupie chorych określa się na 5-7%.
U chorych na hemofilię B (mających niedobór czynnika IX) inhibitory pojawiają się znacznie rzadziej (u mniej niż 3% osób). Z tego powodu jest mniej dostępnych informacji na temat ryzyka pojawiania się inhibitorów czynnika krzepnięcia IX.
Postać hemofilii
| HEMOFILIA ŁAGODNA 5%-50% prawidłowej aktywności czynnika krzepnięcia |
|
| HEMOFILIA UMIARKOWANA 1%-5% prawidłowej aktywności czynnika krzepnięcia |
|
| HEMOFILIA CIĘŻKA Poniżej 1% prawidłowej aktywności czynnika krzepnięcia |
|
Wiemy, że u niektórych chorych na hemofilię B, w odpowiedzi na podawany czynnik IX, mogą wystąpić ciężkie reakcje alergiczne, włącznie z wstrząsem anafilaktycznym. Ze względu na to zagrożenie, pierwsze 10-20 podań koncentratów czynnika IX powinno odbywać się w ośrodku leczenia chorych na hemofilię.
Dzieci i dorośli, u których niedawno rozpoznano hemofilię, pomiędzy 1. a 50. podaniem czynnika powinni być regularnie badani pod kątem powstania inhibitora czynnika krzepnięcia. Chorzy na ciężką postać hemofilii powinni być regularnie badani w kierunku inhibitora również później, po upływie pierwszych 50. dni leczenia.
Takie badania powinny być przeprowadzane 1 lub 2 razy do roku. Test w kierunku inhibitora czynnika krzepnięcia należy również wykonywać przed każdą operacją chirurgiczną.
JAKIE CZYNNIKI MOGĄ WPŁYWAĆ NA RYZYKO POJAWIENIA SIĘ INHIBITORA
Jest kilka czynników, które zwiększają ryzyko pojawienia się inhibitora. Są to:- występowanie inhibitora u krewnego chorego,
- poważne uszkodzenia w genie czynnika krzepnięcia,
- afrykańskie pochodzenie,
- wczesne, intensywne leczenie dużymi dawkami koncentratu czynnika krzepnięcia.
Badania wykazały, że u osób chorych na hemofilię objętych leczeniem profilaktycznym (otrzymujących regularnie czynniki krzepnięcia, aby uniknąć krwawień) znacznie rzadziej wytwarza się inhibitor czynnika krzepnięcia.
JAKIE SĄ OZNAKI WYTWORZENIA INHIBITORA
U chorego na hemofilię, u którego wytworzył się inhibitor czynnika krzepnięcia, podawany koncentrat przestaje być skuteczny.
Można przypuszczać, że u chorego wytworzył się inhibitor, gdy leczenie nie przynosi spodziewanych efektów.
Objawy wskazujące na pojawienie się inhibitora:
- dotychczas stosowane dawki koncentratu czynnika krzepnięcia nie powstrzymują krwawienia,
- dotychczasowe leczenie staje się znacznie mniej skuteczne,
- zapobieganie krwawieniom jest znacznie trudniejsze.
Diagnoza oparta na tych objawach powinna jednak zostać potwierdzona badaniami laboratoryjnymi. Czasem inhibitory są rozpoznawane podczas rutynowych badań laboratoryjnych.
JAK DIAGNOZUJEMY INHIBITORY
Test na obecność inhibitora opiera się na pomiarze tzw. czasu aktywacji częściowej tromboplastyny (APTT). Badanie mierzy, jak długo powstaje skrzep. Kiedy inhibitory są obecne, proces tworzenia skrzepu trwa dłużej, a krew nie koaguluje całkowicie, nawet po zmieszaniu z normalnym osoczem.
Metoda oznaczania inhibitora oraz określania jego miana (ilości przeciwciał) nosi nazwę testu Bethesda. Może być on wykonywany w tzw. modyfikacji Nijmegen. Są to metody trudne i wymagające specjalistycznej wiedzy, dlatego są dostępne jedynie w wybranych laboratoriach.
Miano inhibitora jest zróżnicowane u poszczególnych osób, podlega zmianom w czasie. Jego wielkość wyraża się w międzynarodowych jednostkach Bethesda (j.B. lub B.U.) Miano większe niż 5 j.B. określamy jako wysokie, a mniejsze niż 5 j.B. jako niskie. Na ogół inhibitory o wysokim mianie działają silniej, szybko też neutralizują podany czynnik krzepnięcia. Inhibitory o niskim mianie są zwykle słabsze i działają wolniej. Nie jest tak jednak w każdym przypadku.
Inhibitory są też klasyfikowane ze względu na siłę odpowiedzi organizmu na podawany czynnik krzepnięcia (czyli nasilenie tzw. odpowiedzi anamnestycznej). U chorego na hemofilię o silnej odpowiedzi miano inhibitora przynajmniej raz przekroczyło 5 j.B., a powtórne podanie czynnika krzepnięcia powoduje szybkie narastanie miana inhibitora.
U chorego o słabej odpowiedzi układu odpornościowego miano inhibitora nigdy nie przekroczyło 5 j.B. i nie narasta po podaniu czynnika krzepnięcia.
| INHIBITORY O WYSOKIM MIANIE |
>5 j.B.
|
| INHIBITORY O NISKIM MIANIE |
<5 j.B.
|
JAK JEST PROWADZONE LECZENIE CHORYCH NA HEMOFILIĘ Z INHIBITOREM
Leczenie chorych z inhibitorem jest znacznie trudniejsze niż leczenie chorych bez inhibitora. Istnieje kilka możliwości leczenia. Decyzje dotyczące jego wyboru powinny brać pod uwagę miano inhibitora i odpowiedź anamnestyczną, miejsce oraz rodzaj krwawienia oraz to, czy osoba rozpoczęła albo planuje rozpocząć program immunotolerancji (zobacz dalej).
Diagnozą i leczeniem chorych na hemofilię z inhibitorem powinny zajmować się ośrodki leczenia hemofilii. W leczeniu chorych najczęściej stosuje się:
- DUŻE DAWKI CZYNNIKÓW KRZEPNIĘCIA. Podawanie koncentratów czynników krzepnięcia często i w dużych dawkach jest podejmowane w przypadku krótkotrwałego krwawienia u osób ze słabą odpowiedzią układu odpornościowego. Poziom czynnika powinien być oznaczony po każdym podaniu, aby upewnić się, że jest on wystarczająco wysoki, by wykazywał działanie terapeutyczne. Czasem użyteczne jest podawanie koncentratu czynnika krzepnięcia w stałym wlewie. Duże dawki koncentratów czynników krzepnięcia są również stosowane w leczeniu nagłych krwawień u osób, u których miano inhibitora było wprawdzie wysokie w przeszłości, jednak w danym momencie jest niewielkie. Po leczeniu należy się jednak liczyć z silną odpowiedzią anamnestyczną, która rozwija się w ciągu 5 do 7 dni. Po tym czasie koncentrat czynnika krzepnięcia należy zastąpić lekami omijającymi.
- LEKI OMIJAJĄCE INHIBITOR. Leki omijające inhibitor, takie jak koncentrat aktywowanych czynników zespołu protrombiny (APCC) i rekombinowany czynnik VIIa (rFVIIa), są wykorzystywane w leczeniu nagłych krwawień u chorych na hemofilię z inhibitorami.
- APCC jest produkowany z osocza ludzkiego. Zawiera zróżnicowane ilości VII, IX i X czynnika krzepnięcia. Podawanie leków trzeba często powtarzać (zazwyczaj w odstępach od 8 do 12 godzin).
- Rekombinowany czynnik VIIa jest uzyskiwany metodą biotechnologiczną. Powinien również być podawany często, zazwyczaj co dwie, trzy godziny.
- KWAS TRANEKSAMOWY. Jest lekiem antyfibrynolitycznym, który może być podawany jako leczenie uzupełniające. Stosuje się go w postaci tabletek lub zastrzyków. Hamuje on rozpuszczanie skrzepów. Jest szczególnie przydatny w przypadku krwawień z błon śluzowych nosa czy jamy ustnej. Należy pamiętać, że nie powinien być stosowany w połączeniu z koncentratem aktywowanych czynników zespołu protrombiny (APCC).
- KWAS AMINOKAPRONOWY. Jest lekiem antyfibrynolitycznym, który może być stosowany jako lek uzupełniający - w postaci tabletek lub zastrzyków. Wspomaga on utrzymanie skrzepu w niektórych częściach ciała, takich jak jama ustna, pęcherz i macica.
- PLAZMAFEREZA. To metoda usuwania inhibitorów z krwioobiegu chorego. Bywa stosowana w rzadkich przypadkach, w stanach nagłych (między innymi przed operacją lub w przypadku poważnego krwawienia), np. w sytuacji, gdy leki omijające nie są wystarczająco skuteczne.
- INDUKCJA IMMUNOTOLERANCJI (ITI). To leczenie polegające na regularnym podawaniu dużych dawek koncentratu czynnika VIII lub IX przez wiele miesięcy, a nawet kilka lat, aby "przyzwyczaić" organizm do czynnika i sprawić, że przestanie na niego reagować wytwarzaniem przeciwciał.
Proces ten jest nazywany indukcją tolerancji immunologicznej. Jeżeli chory zamierza poddać się indukcji immunotolerancji, ale jeszcze jej nie rozpoczął, to wówczas do leczenia nagłych krwawień zaleca się nie używać koncentratów czynników krzepnięcia. Mogą one bowiem spowodować wzrost miana inhibitora.
NA CZYM POLEGA INDUKCJA IMMUNOTOLERANCJI
W trakcie indukcji tolerancji immunologicznej koncentrat czynnika krzepnięcia podaje się choremu regularnie, aż do czasu, gdy układ odpornościowy przestanie na niego reagować. Gdy indukcja immunotolerancji kończy się powodzeniem, inhibitory zanikają, a proces krzepnięcia po podaniu czynnika wraca do normy. U większości osób leczonych w programach ITI widać poprawę już w ciągu 12 miesięcy, jednak w trudniejszych przypadkach może to potrwać nawet dwa lata albo dłużej.
Indukcja immunotolerancji

Obecnie stosuje się różne schematy indukcji immunotolerancji. Badania nad najlepszą metodą wywoływania ITI nadal trwają. Codziennie podawane duże dawki czynnika krzepnięcia mogą wywołać immunotolerancję szybciej, ale ten sposób postępowania jest droższy i niesie inne zagrożenia niż te, które mogą pojawić się przy rzadszym podawaniu mniejszych dawek koncentratu czynnika krzepnięcia.
W trakcie przygotowywania tej publikacji trwały badania nad indukcją immunotolerancji (www.itistudy.com) Celem badania jest porównanie skuteczności i bezpieczeństwa różnych schematów dawkowania. Wyniki pomogą poprawić skuteczność ITI u chorych z inhibitorami we wszystkich krajach.
JAKIE CZYNNIKI WPŁYWAJĄ NA WYNIK INDUKCJI IMMUNOTOLERANCJI
Nadal nie jest jasne, dlaczego indukcja immunotolerancji jest łatwiejsza u niektórych osób. Są jednak pewne czynniki, które mogą wpłynąć na skuteczność ITI:
- rozpoczęcie ITI, gdy poziom inhibitora jest niższy niż 10 j.B./ ml, a najlepiej poniżej 5 j.B./ ml;
- rozpoczęcie ITI u osób, u których inhibitor nie przekroczył 200 j.B./ ml, a najlepiej utrzymuje się stale poniżej 50 j.B./ ml;
- rozpoczęcie ITI w ciągu 5 lat od wystąpienia inhibitora.
Zbyt wczesne zakończenie leczenia bądź przerwy w jego trakcie (nieregularne podawanie koncentratu czynnika krzepnięcia) mogą mieć wpływ na powodzenie immunotolerancji albo na jej czas.
Odwiedź stronę World Federation of Hemophilia (www.wfh.org), aby dowiedzieć się więcej o inhibitorach.
| Tłumaczenie publikacji "What are inhibitors" ze strony: www.wfh.org World Federation of Hemophilia 1425 René Lévesque Boulevard West, Suite 1010 Montréal, Québec H3G 1T7 CANADA |